Микробная загрязненность воздуха в птичнике
Содержание
- Микробная загрязненность воздуха в птичнике
- Токсикологические параметры препарата М-340
- Определение микробной обсемененности воздуха в помещениях птицеводческих хозяйств яичного направления по сезонам года
- Борьба с пылевой загрязненностью предусматривает:
- Физико-химическая характеристика препарата М-340
- Методические указания к заданиям
А. Сидорова, Красноярский ГАУ
Данные наших исследований свидетельствуют, что веский аргумент в пользу клеточного выращивания бройлеров — лучшее санитарное состояние воздуха птичников и, как следствие, более высокие экономические показатели.
Эксперимент проводили на Березовской фабрике. При этом изучали бактериальную загрязнённость воздуха птичников и влияние различных микроорганизмов на продуктивность и жизнеспособность птицы с расчётом коэффициентов корреляции, затрат кормов на единицу продукции. После убоя бройлеров был рассчитан европейский показатель эффективности выращивания ЕРЕF по формуле: (М*А)/ (D*C*10), где М — живая масса 1 головы, г; А — сохранность поголовья, %; D — конверсия корма, кг; С — убойный возраст, дн.
Для определения количества и видового состава микроорганизмов использовали седиментационный метод.
Согласно полученным данным, в течение первого месяца выращивания бройлеров воздух всех птичников стерилен по сальмонелле. Первые её колонии появляются в отдельных птичниках через 40 дней содержания птицы и только зимой обнаружены во всех птичниках. Однако количество сальмонелл в это время года в 1 м3 воздуха незначительно — 2 тысячи микробных тел. При напольном же выращивании бройлеров воздух свободен от сальмонелл лишь первые 10 дней. В дальнейшем их концентрация в десятки раз выше, чем при клеточном содержании.
Наиболее устойчивые из микроорганизмов стафилококки. Исследования показали, что дезинфекция птичников во время профилактических перерывов 38-40%-ным раствором формалина не даёт 100%-ной стерильности. Так, зимой, весной и осенью свободны от стафилококка 55% обследованных птичников, летом — 10%. В следующие периоды загрязнённость воздуха увеличивается. Наибольшее количество — 56 тысяч микробных тел — обнаружено в зимний период в конце выращивания.
При напольном содержании стафилококки обнаруживаются во всех птичниках сразу после заселения птицы, притом их концентрация в десятки раз больше, особенно в зимний период. Значительное превышение можно объяснить тем, что при напольном выращивании трудно поддерживать подстилку в хорошем состоянии, поэтому при недостаточной вентиляции в осенне-зимний период в воздухе накапливается большое количество аммиака — благоприятной среды для развития стафилококка.
Условно-патогенная микрофлора из группы кишечной палочки при неблагоприятных условиях может вызвать колибактериоз. Однако при клеточном выращивании бройлеров количество кишечной палочки во все сезоны было незначительно (максимальное число в конце выращивания в зимний период — 7 тысяч микробных тел). При напольном кишечная палочка выделялась уже в первый день после размещения птицы. Наибольшая её концентрация отмечалась в зимний период — 509 тысяч бактерий, что приводит к вспышкам колибактериоза и нарастанию падежа.
Снижение зоотехнических показателей при увеличении микробной загрязнённости воздуха птичников подтверждают рассчитанные коэффициенты корреляции. Из всех микроорганизмов наибольшее влияние на снижение среднесуточных приростов оказывают стафилококки (г= -0,2), на сохранность поголовья — общее микробное число (г= -0,4).
Условия содержания оказали соответствующее влияние на продуктивность и жизнеспособность бройлеров и соответственно на экономику. Европейский показатель эффективности выращивания ЕРЕF при клеточном способе по сравнению с напольным больше минимум на 34 единицы. Санитарная оценка воздушной среды птичников позволяет сделать следующие выводы: микробная загрязнённость воздуха птичников во все периоды при клеточном выращивании бройлеров не превышает допустимых норм, при напольном способе — только первые 10 дней.
Преимущество клеток по сравнению с напольным способом — лучшее санитарное состояние воздуха, более высокие показатели продуктивности и жизнеспособности птицы. При оценке санитарного состояния воздушной среды птичников во время профилактических перерывов и по периодам выращивания необходимо усилить контроль по стафилококку и кишечной палочке.
Печать
3801
Токсикологические параметры препарата М-340
Препараты, используемые для дезинфекции в присутствии птиц и животных, в соответствии с требованиями, предъявляемыми к ним, наряду с высокими бактерицидными и дезинфицирующими свойствами не должны оказывать вредного воздействия на организм животного, птиц и человека. Учитывая это, нами были проведены исследования по изучению токсикологических параметров М-340.
Определение параметров острой токсичности на лабораторных животных
Эксперименты по определению острой токсичности М-340 проводили с использованием белых мышей, живой массой 18-20 г.
Препарат вводили белым мышам перорально однократно в нативном виде натощак. За подопытными животными вели ежедневные наблюдения в течение 14 суток после введения препарата, учитывая количество павших животных, клиническую картину интоксикации, время гибели животного с момента введения препарата, результаты патологоанатомического вкрытия павших животных. Контрольным животным вводили адекватное количество дистиллированной воды. При этом было установлено, что признаки интоксикации и гибель подопытных животных зависело от дозы введенного препарата. Результаты изучения острой оральной токсичности препарата М-340 при внутрижелудочном введении обобщены и приведены в таблице 20.
Абсолютно смертельной дозой, при которой отмечалась типичная клиническая картина интоксикации и гибель всех подопытных мышей в течение 3-6 часов, являлась 1100 мг/кг. При патологоанатомическом вскрытии павших мышей выявили следующие изменения: общий венозный застой, отек легких, асфиксию сердца и катаральный гастроэнтерит.
Расчеты, проведенные по Керберу показали, что ЛД50 препарата М-340 для белых мышей составляло 891,7 мг/кг.
Таким образом, максимально переносимая доза (МПД) М-340 для взрослых белых мышей равна 600 мг/кг; абсолютно-смертельная — 1100 мг/кг; среднесмертельная (LD50) — 891,7 мг/кг. Исходя из этих данных согласно ГОСТ 12.1.007-76 препарат М-340 относится к среднетоксичным веществам (Ш классу опасности).
Определение раздражающего действия препарата М-340 на кожу и слизистые оболочки
При проведении дезинфекции в помещении в присутствии животных и птиц наибольший интерес представляет изучение действия данного препарата на кожу и слизистые оболочки. В связи с этим мы провели изучение особенностей местно-раздражающих, резорбтивных и аллергизирующих свойств М-340.
Оценку раздражающего действия препарата М-340 осуществляли на основе наблюдений за изменениями слизистых оболочек глаза, склеры и роговицы животных с использованием 4-х кроликов.
Препарат М-340 наносили в коньюнктивальный мешок левого глаза кроликов в виде водного 0,5; 1 и 2%-ного раствора, правый глаз служил контролем (наносили физиологический раствор). После закапывания препарата в глаз на 1 минуту прижимали носослезныи канал у внутреннего его угла. Наблюдение за состоянием слизистой оболочки и прозрачностью роговицы осуществляли в течение недели с момента закапывания растворов.
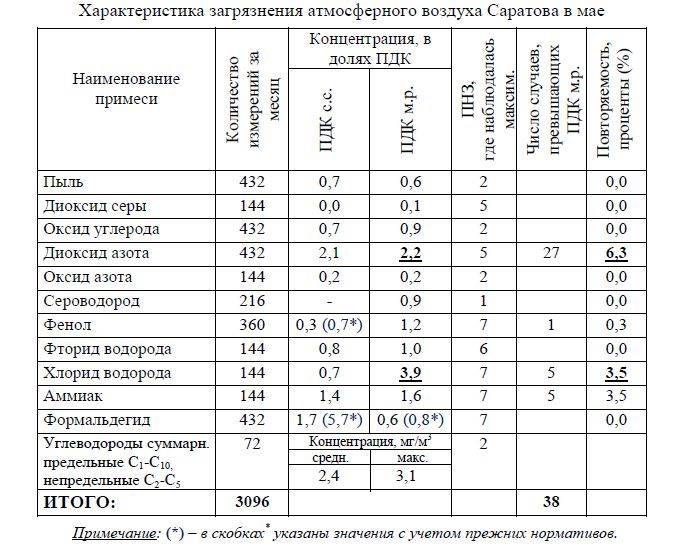
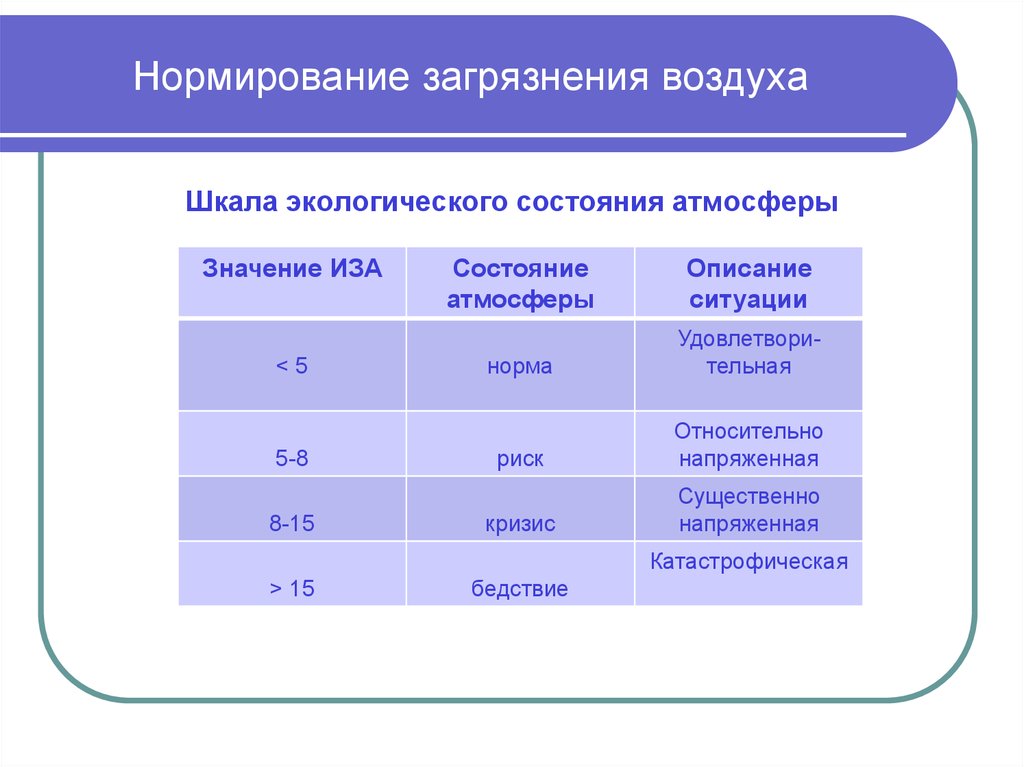
Определение микробной обсемененности воздуха в помещениях птицеводческих хозяйств яичного направления по сезонам года
Основным предназначением цеха ремонтного стада является подготовка здорового высокопродуктивного молодняка для частичной или полной замены взрослого поголовья промышленного и родительского стада. В зависимости от участка комплектации, указанного в технологическом графике, выращивание птицы осуществляется в следующем порядке: для восполнения родительского стада — до 22, для промышленного — 17 недельного возраста. Особенностью данного цеха является то, что при 17-ти недельном сроке содержания птицы можно достичь трехразового использования помещений в течение года.
На протяжении всего периода наших исследований оборот позиции №13 был двухразовый. Выращивание птицы при первом технологическом цикле длилось в течение 19-недель, во втором — 17 недель. Первое поступление птицы суточного возраста в подготовленную позицию №13 было осуществлено после профилактического отдыха (21 день) в начале ноября 2000 года, а второе — в конце апреля.
Одной из задач наших исследований было проследить в данном цехе динамику роста численного состава микроорганизмов в воздухе по сезонам года и выяснить влияние уровня микробной обсемененности и микроклимата птичника на организм птицы.
Результаты изучения бактериальной обсемененности цеха по выращиванию ремонтного молодняка на протяжении всего года приведены в таблице 3.
Осенний период исследований совпал со временем выращивания птицы от 1 до 60, зимний — от 60 до 119, весенний — от 1 до 90, летний — от 90 до 154 дневного возраста. Предельно допустимая норма микробного фона в осеннее и весеннее время составляет 60-150 тыс.м.т./м3, а в зимнее и летнее -180 тыс. м.т./м3.
Анализ микробной обсемененности воздуха позиции №13 по сезонам года (табл. 3) дает возможность оценить санитарное состояние помещения. Так, наибольший микробный фон в воздухе отмечался в зимний (сред, значение — 743,7+2,8 тыс. м.т./м3), а наименьший — в осенний (сред, значение — 157,7+1,5 тыс. м.т./м3) периоды. Показатели микробной загрязненности в весенний сезон года были выше предельно допустимого уровня в среднем в 3,8 раза. Фактические данные, полученные зимой, превышали ПДК в среднем в 4,1, а летом-в 1,4 раза.
Содержание микроорганизмов в пробах воздуха, взятых с нижнего уровня, в большинстве случаев, было выше и находилось в соотношении с верхним 1,1:1 — 1,5:1. При рассмотрении участка отбора проб по диагонали помещения, наибольшая степень обсемененности воздуха микроорганизмами отмечалась в серединной части. Так, численный состав бактерий в середине птичника был выше торцовых в 1,1 -1,4 раза (Р 0,05).
Проведение профилактического перерыва отразилось на поддержании низкого количественного состава микрофлоры в воздухе птичника №13 в осенний период. К зимнему сезону года численность микрофлоры увеличивалась в 4,7 раза. Перевод птицы в конце февраля в цех для содержания взрослой птицы и организация в марте профилактического отдыха помещения, позволил не только удержать рост уровня микробной обсемененности в весеннее время года, но и снизить ее в 1,3 раза.
Для выявления динамики размножения бактерий в весеннее время и выяснения степени ее влияния на состояние молодняка был проведен опыт по исследованию уровня микробной обсемененности воздуха в течение одной недели. Численный состав бактерий определялся до и после заполнения позиции птицей. Температура в помещении за этот период составляла в среднем 32-33С. Полученные результаты исследований нами представлены в таблице 4. Результаты опыта показали, что количество бактерий в воздухе за 7 дней увеличилось в цыплятнике в среднем в 17 раз (Р 0,001). Исследование состояния здоровья птицы в этот период свидетельствовало, что количество больных желудочно-кишечными заболеваниями к концу недели достигло в среднем 20% от общего поголовья.
Признаки диареи среди цыплят регистрировали на 4-е сутки. Таким образом, увеличение степени загрязнения воздушной среды микроорганизмами вело к росту заболевания среди молодняка птицы.
Дальнейшей задачей наших исследований являлось установление видового состава выделяемых микроорганизмов из воздуха птичника. При микроскопии мазков в воздушной среде позиции №13 отмечено присутствие: грамположительных кокков расположенных одиночно, попарно и в виде цепочки; сарцин; спорообразующих палочек и грамотрицательных коротких, тонких палочек. Дальнейшее изучение физиологических, биохимических свойств, а также идентификация выделенных культур помогло проанализировать видовую характеристику бактерий, присутствующих в воздушном пространстве данного птичника на протяжении всего года (табл.5).
Борьба с пылевой загрязненностью предусматривает:
07.01.2013 15:52
создание вокруг ферм защитных кольцевых полос из зеленых насаждений;
укрепление поверхностного слоя почвы на территории ферм путем посева многолетних трав или оборудования твердого покрытия;
проведение только влажной уборки полов и проходов в помещениях;
проведение чистки кожи животных вне основного помещения;
недопущение перетряхивания в помещении корма и подстилки;
обеспечение бесперебойной работы вентиляции, оборудование вентиляционных устройств пылезащитными фильтрами.
Допустимая концентрация пыли в животноводческих помещениях составляет 0,5—3 мг/м3, в птицеводческих помещениях — 1,5—6,0 мг/м3.
Основную массу микробов воздуха составляют сапрофиты (около 1200 видов бактерий и актиномицетов, около 40000 видов грибов, мхов, папоротников). В поверхностных слоях атмосферы больше плесеней, а у земли больше бактерий, иногда патогенных.
В атмосферном воздухе значительная часть микроорганизмов погибает под воздействием солнечных лучей. Но в воздухе животноводческих помещений, наоборот, создаются условия, способствующие их росту. К ним относятся повышенные температура и влажность, запыленность воздуха, отсутствие ультрафиолетовых лучей, скученное содержание животных. Все это увеличивает контакт микроорганизмов с животными, способствует распространению болезней, в том числе и остро инфекционных, таких как ящур, туберкулез, чума и др. Чтобы избежать передачи возбудителей инфекционных болезней, необходимо своевременно изолировать больных животных от здоровых, провести соответствующую дезинфекцию и очистку помещения, постоянно проводить профилактические мероприятия, направленные на борьбу с пылью и микробной обсемененностью воздуха помещений.
Кроме этого выбросы воздуха животноводческих помещений загрязняют окружающую атмосферу, могут распространяться воздушным потоком на большие расстояния, создавая опасность как для животных, так и людей. Вот почему необходимо вентиляционные вытяжные устройства делать по возможности выше. Установлено, что с десятикратным увеличением их высоты концентрация вредных веществ и микроорганизмов уменьшается в 100 раз. Большого внимания требует сохранение или устройство зеленых насаждений, задерживающих пыль, дым, газы и микроорганизмы. Навозохранилища и очистные сооружения также обсаживают кустарником и деревьями. Содержание пыли после прохождения полосы зеленых насаждений уменьшается на 72,8%, а количество микроорганизмов — на 52,6%. Пыль и переносимые с нею микроорганизмы оседают на листьях деревьев и гибнут под действием выделяемых листьями фитонцидов.
К мерам борьбы с запыленностью и микробной обсемененностью воздуха животноводческих помещений следует отнести как надежную систему вентиляции, так и искусственную аэроионизацию, которая в 3-4 раза уменьшает запыленность и в 3—5 раз — количество микроорганизмов. Наряду с этим необходимо регулярно проводить санитарные дни, обеспечить строгую санитарную защиту животных (наличие санпропускников, дезванн, дезподушек, санитарных тамбуров и др.), своевременно выявлять и изолировать больных животных, регулярно применять лампы ультрафиолетового облучения и т. д.
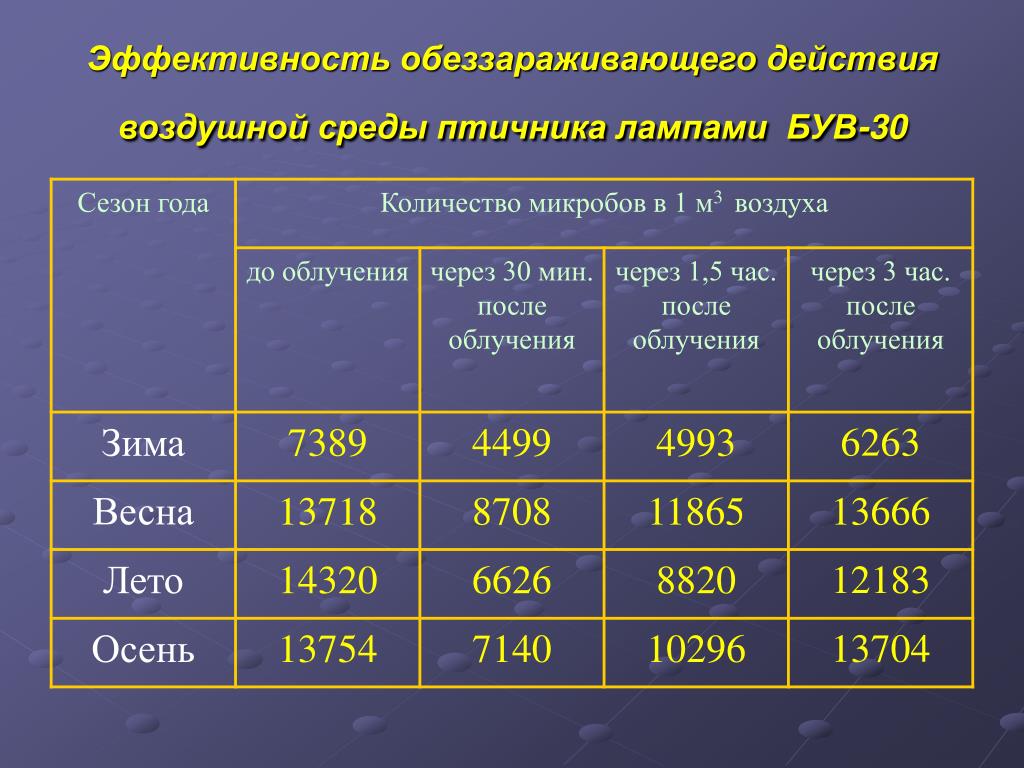
Для обеззараживания воздуха в помещениях (операционные, ветлечебницы, помещения для молодняка и др.) можно использовать бактерицидные лампы типа ДБ-15, ДБ-30, ДБ-60.
В соответствии с нормами технологического проектирования допускается наличие следующего количества микроорганизмов в следующих животноводческих помещениях (в тыс. микробных тел в 1м3 воздуха) для крупного рогатого скота — не более 70, для телят — 20, для телят старшего возраста — 40, для поросят младшего возраста и подсосных свиноматок не более 50, для свиней на откорме — 80, для холостых и легкосупоросных свиноматок — 100, для хряков-производителей — 60, в овчарнях — не более 50-70, в птичниках — 50-200.
| < Предыдущая | Следующая > |
|---|
Физико-химическая характеристика препарата М-340
При выборе препаратов для дезинфекции важное значение имеют бактерицидные свойства, которые определяют перспективность его применения. Результаты изучения бактерицидной активности растворов препарата М-340 представлены в таблице 17
Результаты изучения бактерицидной активности растворов препарата М-340 представлены в таблице 17.
Представленные в таблице 17 данные свидетельствуют, что бактерицидная активность препарата по отношению к Escherichia coli- штамм №7904, Salmonella enteritidis- штамм №418 и Staphylococcus aureus штамм Р-209 проявлялась по-разному. Бактерицидный эффект на протяжении 30 минут по отношению к Staphylococcus aureus, Escherichia coli и в течение 20 минут — к Salmonella enteritidis был достигнут при воздействии 0,5%-ного раствора. При непосредственном контакте с 1%-ным раствором М-340 Salmonella enteritidis погибала в течение 10 минут, бактерии: Staphylococcus aureus и Escherichia coli — через 20 минут. Взаимодейстие Staphylococcus aureus и Escherichia coli с 1,5%-ным раствором М-340 приводило к 100%-ной их гибели в интервале 10 минут. Таким образом, в данных экспериментах установлена высокая бактерицидная активность препарата М-340.
Изучение обезвреживающей активности препарата М-340 в аэрозольном состоянии с целью санации воздуха помещений проводили в условиях камеры методом последовательного распыления суспензий (500 тыс. м.т./м3) тест-микробов (Escherichia coli, Salmonella enteritidis и Staphylococcus aureus) и раствора препарата М-340. Расход раствора препарата М-340 при диспергировании с различной коцентрациеи действующего вещества варьировал от 20 до 40 мл на 1 м3 камеры. Результаты одного из трехкратно повторенных опытов обобщены и представлены в таблице 18.
Полученные данные свидетельствуют о том, что уничтожение Escherichia coli и Staphylococcus aureus 0,5%-ным раствором удается по истечению 30 минут, a Salmonella enteritidis — 20 минут. Действие на протяжении 10 минут 1%-ным раствором М-340 оказалось губительным для Salmonella enteritidis и Staphylococcus aureus. К аэрозоли 1% раствора М-340 среди всех тест-культур только Escherichia coli проявляла относительную устойчивость, ее гибель регистрировали по истечению 30 минут. Уничтожение данной культуры в первые минуты достигалось при распылении 3%-ных концентраций М-340.
Таким образом, результаты экспериментальных исследований показали, что применение данного препарата в аэрозольном состоянии для санации воздуха помещений досточно эффективно при концентрации препарата не ниже 1% из расчета 20-40 мл/м3 помещения.
Методические указания к заданиям
Микробная
загрязненность воздуха имеет большое
эпидемиологическое значение, так как
через него могут передаваться многие
инфекционные заболевания. Микроорганизмы
находятся в воздухе в виде бактериального
аэрозоля (дисперсионная среда — воздух,
дисперсная фаза — капельки жидкости
или твердые частицы, содержащие
микроорганизмы). Различают три фазы
микробного аэрозоля:
-
крупноядерную
жидкую фазу с диаметром капель более
0,1 мм; -
мелкоядерную
жидкую фазу с диаметром капель менее
0,1 мм; -
фазу бактериальной
пыли.
Способность
микробов сохраняться в той или иной
фазе аэрозоля определяется их устойчивостью
к высушиванию. Например, в крупноядерной
фазе выживают даже малостойкие
микроорганизмы (вирусы гриппа, кори и
др.), в мелкоядерной фазе — палочки
дифтерии, стрептококки, менингококки,
в фазе бактериальной пыли — микобактерии
туберкулеза, споры бактерий, грибы.
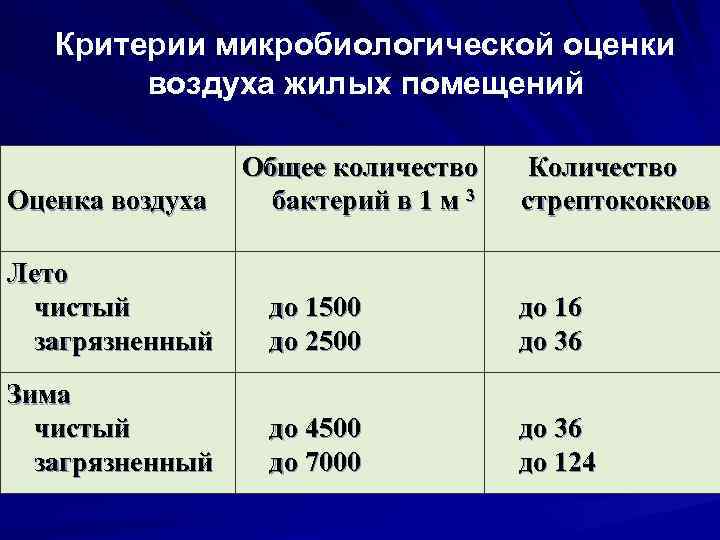
Чистоту воздуха
помещений оценивают на основании
определения общего количества
микроорганизмов, содержащихся в 1 м3
воздуха, и
наличия санитарно-показательных
микроорганизмов (гемолитических
стрептококков и стафилококков) — обычных
обитателей дыхательных путей человека.
Особенно важно
контролировать микробное загрязнение
воздуха в хирургических и педиатрических
отделениях больниц, родильных домах,
где возникновение госпитальных инфекций
наиболее опасно
Здесь главное внимание
должно уделяться определению наличия
патогенных стафилококков и других
патогенных бактерий — возбудителей
послеоперационных и послеродовых
инфекций и заболеваний новорожденных.
В качестве показательных микроорганизмов
для оценки воздушной среды используют
патогенные (коагулазоположительные)
гемолитические стафилококки
При систематическом
контроле обнаружение небольшого
количества патогенных стафилококков
в отделениях, где отсутствует госпитальная
инфекция, закономерно и не рассматривается
как выходящее за рамки допустимого.
Показателем санитарного неблагополучия
является большое, особенно нарастающее,
обсеменение лечебных учреждений этими
микроорганизмами.
При оценке результатов
необходимо установить, какое место
среди обнаруживаемых патогенных
стафилококков занимают виды, устойчивые
к антибиотикам, и не преобладает ли
среди высеваемых культур какой-либо
один или немногие фаготипы. Нарастание
количества патогенных стафилококков
при одновременном сужении круга их
типов и повышении удельного веса
полирезистентных к антибиотикам форм
следует рассматривать как возможность
появления госпитальных инфекций.
Плановые исследования
воздуха на общую бактериальную
обсемененность и наличие золотистых
стафилококков проводят один раз в месяц
в операционных, асептических, реанимационных
палатах хирургических отделений,
родильных залах и детских палатах
акушерских стационаров; по показаниям
на наличие грамотрицательных
микроорганизмов — в асептических
отделениях.
По эпидемическим
показаниям спектр определяемых в воздухе
микроорганизмов может быть расширен.
В табл. 3.4 представлены
допустимые уровни бактериальной
обсемененности воздуха.
Таблица 3.4. Допустимые
уровни бактериальной обсемененности
воздуха